AGHI CANNULA
AGO CANNULA, 2 VIE,
BD VENFLON PRO SAFETY 18G 1,3 x mm32 VERDE CF.50PZ
Descrizione
Ago catetere venoso periferico di sicurezza, monouso, sterile, con meccanismo di sicurezza ad attivazione passiva e irreversibile, con valvola di iniezione.
NUMERO VIE: 2
CALIBRO: G18
DIAMETRO INTERNO: 0,91 mm
DIAMETRO ESTERNO: 1,3 mm
LUNGHEZZA: 32 mm
FLUSSO ml/min: 103
CODICE COLORE: Verde
Caratteristiche generali
• Dispositivo di protezione con sistema antispillaggio per l’eliminazione dei rischi di puntura accidentale (percutaneo) e di contatto accidentale con schizzi di sangue (mucocutaneo)
• Cannula a parete sottile e rastremata (a doppia svasatura)
• Ago interno lubrificato, estraibile, in acciaio con punta a triplice affilatura e dotata di sfaccettatura dorsale (back-cut-grinding) per ridurre il trauma
• Cono di connessione luer/luer lock, resistente alla trazione
• N° 6 bande radio-opache incorporate nella parete della cannula, non a contatto con il sangue o i fluidi infusi
• Valvola unidirezionale antireflusso in silicone
• Alette flessibili prepiegate che permettono di impugnare l’ago cannula con più punti di appoggio
• Tappo/Membrana distale con microfori per un facile reflusso in fase di inserimento
• Accesso alla seconda via dotato di cappuccio di sicurezza con meccanismo a “battuta” (a scatto) con codice colore con sistema di chiusura automatica
• Camera di reflusso trasparente, dotata di tappo a tenuta
Tempi di permanenza consigliati:
BD non indica un tempo di permanenza minimo o massimo in situ per questo tipo di cateteri.
Il tempo di permanenza deve essere stabilito dalle procedure emanate dagli Enti, dalle linnee guida nazionali, da ogni contesto clinico e dalla condizione clinica specifica del singolo paziente.
Se ben gestito e costantemente monitorato (come indicato dalle linee guida CDC- Atlanta e INS), il dispositivo può rimanere in situ per tempi superiori a 72/96 ore.
Resistenza alle pressioni:
Massimo 188 psi
Destinazione d’uso / Indicazioni:
Catetere venoso periferico per l’incannulazione a breve termine, i prelievi ematici, il monitoraggio della pressione e la somministrazione endovenosa di liquidi.
Controindicazioni:
Nessuna nei limiti della destinazione d’uso del prodotto
Compatibilità con prodotti farmaceutici:
Si dichiara la conformità alle normative ISO ed EN in materia.
Non sono note limitazioni particolari nella scelta di fluidi o farmaci da somministrare.
È necessario attenersi a tutte le avvertenze, precauzioni, istruzioni e controindicazioni relative alle sostanze infuse, compresi fluidi, farmaci, sangue o emoderivati, e mezzi di contrasto, così come specificato dalle case farmaceutiche produttrici.
Specifiche tecniche:
• Cono di connessione luer/luer lock: Polipropilene trasparente
• Alette laterali di fissaggio: Polipropilene
• Cappuccio copricatetere: Polietilene
• Catetere/Cannula: Vialon X (Poliuretano Aromatico ad uso medicale)*
• Camera di reflusso trasparente: Polipropilene
• Membrana (tappo) di reflusso: Polipropilene
• Bande radiopache: Solfato di Bario
• Ago-mandrino: Acciaio inossidabile AISI 304
• Valvola unidirezionale: Gomma siliconica
• Cappuccio della valvola: Polietilene
• Tappo luer lock: Polipropilene
• Impugnatura: Polipropilene
• Sistema di protezione: Polipropilene
• Lubrificante: Silicone in quantità inferiore a 0,25mg/cm², limite massimo indicato dalla Farmacopea Ufficiale Italiana e e conforme alle norme ISO 7886-2 e ISO 7886-1
* Vialon™ è un poliuretano termoplastico, resistente al piegamento che si ammorbidisce a contatto con il flusso ematico e riduce quindi le sollecitazioni meccaniche sulle pareti dei vasi.
• Sterile: SI
• Presenza di lattice: NO
• Presenza di DEHP: NO
• Presenza di PVC: NO
• Modalità e durata di conservazione: Conservare in un luogo fresco ed asciutto lontano da sostanze chimiche
Conformità:
§ ISO 10993-1 “Biological Evaluation of Medical Devices Part 1: Guideline on Selection of Tests – Corrigendum 1”
§ISO 11137-1 “Sterilization of health care products. Radiation. Requirements for development, validation and routine control of a sterilization process for medical devices”
§ ISO 11607 “Packaging for Terminally Sterilized Medical Devices”
§ EN 594-1 “Conical Fittings with a 6% (Luer) Taper for Syringes, Needles and Certain Other Medical Equipment Part 1: General Requirements”
§ EN 594-2 “Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical equipment — Part 2: Lock fittings.”
§ ISO 14971 ” Medical Devices – Application of Risk Management to Medical Devices”
§ ISO 10555 Part 1 “Sterile, Single-Use Intravascular Catheters — Part 1: General Requirements”
§ ISO 10555 Part 5 “Sterile, Single-Use Intravascular Catheters — Part 5: Over-the-Needle Peripheral Catheters”
§ ISO 14971 “Medical devices — Application of risk anagement to medical devices”
§ EN 980 “Symbols for use in the labeling of medical devices”
Confezionamento ed etichettatura:
Il confezionamento primario e secondario è prodotto senza l’impiego di lattice, di ftalati e di PVC
Primario:
Peel-pack in blister preformato PVC Free e carta per uso medicale permeabile all’ossido di etilene riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conforme alla normativa ISO 11607, EN 980 ed EN 1041.
Secondario:
Cartone pressato riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conformi alla normativa EN 980 ed EN 1041.
Imballo:
Cartone ondulato riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conformi alla normativa EN 980 ed EN 1041.
Metodo di sterilizzazione del prodotto:
Irraggiamento, conforme ai requisiti stabiliti dalla norma ISO 11137-1.
Biocompatibilità:
Il prodotto è stato realizzato con materiali, coloranti ed inchiostri atossici.
I materiali utilizzati sono stati testati per valutare la tossicità secondo quanto indicato dalle normative ISO 10993-1.
Si dichiara l’apirogenicità del prodotto.
Smaltimento:
I dispositivi medici appuntiti, acuminati, contaminati da sangue o altri fluidi organici, devono essere smaltiti negli appositi contenitori ed eliminati tramite incenerimento. Lo smaltimento deve comunque avvenire in conformità alla direttive nazionali, comunitarie ed internazionali in materia. In ogni caso si consiglia di fare riferimento ai vigenti protocolli ospedalieri.
Controlli qualitativi:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazione degli organi preposti.
Modalità di conservazione:
A temperatura ambiente (non superiore ai 30°C), in luogo fresco e asciutto al riparo dai raggi solari diretti
Confezione: 50 Pezzi
CND: C0101010201
Repertorio: 35907
CLASSE CE: IIA
AGO CANNULA, 2 VIE,
BD VENFLON PRO SAFETY 20G 1,1 x mm32 ROSA CF. 50PZ
Descrizione
Ago catetere venoso periferico di sicurezza, monouso, sterile, con meccanismo di sicurezza ad attivazione passiva e irreversibile, con valvola di iniezione.
NUMERO VIE: 2
CALIBRO: G20
DIAMETRO INTERNO: 0,74 mm
DIAMETRO ESTERNO: 1,1 mm
LUNGHEZZA: 32 mm
FLUSSO ml/min: 67
CODICE COLORE: Rosa
Caratteristiche generali
• Dispositivo di protezione con sistema antispillaggio per l’eliminazione dei rischi di puntura accidentale (percutaneo) e di contatto accidentale con schizzi di sangue (muco cutaneo)
• Cannula a parete sottile e rastremata (a doppia svasatura)
• Ago interno lubrificato, estraibile, in acciaio con punta a triplice affilatura e dotata di sfaccettatura dorsale (back-cut-grinding) per ridurre il trauma
• Cono di connessione luer/luer lock, resistente alla trazione
• N° 6 bande radio-opache incorporate nella parete della cannula, non a contatto con il sangue o i fluidi infusi
• Valvola unidirezionale antireflusso in silicone
• Alette flessibili prepiegate che permettono di impugnare l’ago cannula con più punti di appoggio
• Tappo/Membrana distale con microfori per un facile reflusso in fase di inserimento
• Accesso alla seconda via dotato di cappuccio di sicurezza con meccanismo a “battuta” (a scatto) con codice colore con sistema di chiusura automatica
• Camera di reflusso trasparente, dotata di tappo a tenuta
Tempi di permanenza consigliati:
BD non indica un tempo di permanenza minimo o massimo in situ per questo tipo di cateteri.
Il tempo di permanenza deve essere stabilito dalle procedure emanate dagli Enti, dalle linnee guida nazionali, da ogni contesto clinico e dalla condizione clinica specifica del singolo paziente.
Se ben gestito e costantemente monitorato (come indicato dalle linee guida CDC- Atlanta e INS), il dispositivo può rimanere in situ per tempi superiori a 72/96 ore.
Resistenza alle pressioni:
Massimo 188 psi
Destinazione d’uso / Indicazioni:
Catetere venoso periferico per l’incannulazione a breve termine, i prelievi ematici, il monitoraggio della pressione e la somministrazione endovenosa di liquidi.
Controindicazioni:
Nessuna nei limiti della destinazione d’uso del prodotto
Compatibilità con prodotti farmaceutici:
Si dichiara la conformità alle normative ISO ed EN in materia.
Non sono note limitazioni particolari nella scelta di fluidi o farmaci da somministrare.
È necessario attenersi a tutte le avvertenze, precauzioni, istruzioni e controindicazioni relative alle sostanze infuse, compresi fluidi, farmaci, sangue o emoderivati, e mezzi di contrasto, così come specificato dalle case farmaceutiche produttrici.
Specifiche tecniche:
• Cono di connessione luer/luer lock: Polipropilene trasparente
• Alette laterali di fissaggio: Polipropilene
• Cappuccio copricatetere: Polietilene
• Catetere/Cannula: Vialon X (Poliuretano Aromatico ad uso medicale)*
• Camera di reflusso trasparente: Polipropilene
• Membrana (tappo) di reflusso: Polipropilene
• Bande radiopache: Solfato di Bario
• Ago-mandrino: Acciaio inossidabile AISI 304
• Valvola unidirezionale: Gomma siliconica
• Cappuccio della valvola: Polietilene
• Tappo luer lock: Polipropilene
• Impugnatura: Polipropilene
• Sistema di protezione: Polipropilene
• Lubrificante: Silicone in quantità inferiore a 0,25mg/cm², limite massimo indicato dalla Farmacopea Ufficiale Italiana e e conforme alle norme ISO 7886-2 e ISO 7886-1
* Vialon™ è un poliuretano termoplastico, resistente al piegamento che si ammorbidisce a contatto con il flusso ematico e riduce quindi le sollecitazioni meccaniche sulle pareti dei vasi.
• Sterile: SI
• Presenza di lattice: NO
• Presenza di DEHP: NO
• Presenza di PVC: NO
• Modalità e durata di conservazione: Conservare in un luogo fresco ed asciutto lontano da sostanze chimiche
Conformità:
§ ISO 10993-1 “Biological Evaluation of Medical Devices Part 1: Guideline on Selection of Tests – Corrigendum 1”
§ISO 11137-1 “Sterilization of health care products. Radiation. Requirements for development, validation and routine control of a sterilization process for medical devices”
§ ISO 11607 “Packaging for Terminally Sterilized Medical Devices”
§ EN 594-1 “Conical Fittings with a 6% (Luer) Taper for Syringes, Needles and Certain Other Medical Equipment Part 1: General Requirements”
§ EN 594-2 “Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical equipment — Part 2: Lock fittings.”
§ ISO 14971 ” Medical Devices – Application of Risk Management to Medical Devices”
§ ISO 10555 Part 1 “Sterile, Single-Use Intravascular Catheters — Part 1: General Requirements”
§ ISO 10555 Part 5 “Sterile, Single-Use Intravascular Catheters — Part 5: Over-the-Needle Peripheral Catheters”
§ ISO 14971 “Medical devices — Application of risk anagement to medical devices”
§ EN 980 “Symbols for use in the labeling of medical devices”
Confezionamento ed etichettatura:
Il confezionamento primario e secondario è prodotto senza l’impiego di lattice, di ftalati e di PVC
Primario:
Peel-pack in blister preformato PVC Free e carta per uso medicale permeabile all’ossido di etilene riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conforme alla normativa ISO 11607, EN 980 ed EN 1041.
Secondario:
Cartone pressato riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conformi alla normativa EN 980 ed EN 1041.
Imballo:
Cartone ondulato riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conformi alla normativa EN 980 ed EN 1041.
Metodo di sterilizzazione del prodotto:
Irraggiamento, conforme ai requisiti stabiliti dalla norma ISO 11137-1.
Biocompatibilità:
Il prodotto è stato realizzato con materiali, coloranti ed inchiostri atossici.
I materiali utilizzati sono stati testati per valutare la tossicità secondo quanto indicato dalle normative ISO 10993-1.
Si dichiara l’apirogenicità del prodotto.
Smaltimento:
I dispositivi medici appuntiti, acuminati, contaminati da sangue o altri fluidi organici, devono essere smaltiti negli appositi contenitori ed eliminati tramite incenerimento. Lo smaltimento deve comunque avvenire in conformità alla direttive nazionali, comunitarie ed internazionali in materia. In ogni caso si consiglia di fare riferimento ai vigenti protocolli ospedalieri.
Controlli qualitativi:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazione degli organi preposti.
Modalità di conservazione:
A temperatura ambiente (non superiore ai 30°C), in luogo fresco e asciutto al riparo dai raggi solari diretti
Confezione: 50 Pezzi
AGO CANNULA, 2 VIE,
BD VENFLON PRO SAFETY 22G 0,9 x mm25 BLUE CF. 50PZ
Descrizione
Ago catetere venoso periferico di sicurezza, monouso, sterile, con meccanismo di sicurezza ad attivazione passiva e irreversibile, con valvola di iniezione.
NUMERO VIE: 2
CALIBRO: G22
MISURE mm: 0.9 x 25
FLUSSO ml/min: 42
CODICE COLORE: Blu
Caratteristiche generali
Caratteristiche generali:
• Dispositivo di protezione con sistema antispillaggio per l’eliminazione dei rischi di puntura accidentale (percutaneo) e di contatto accidentale con schizzi di sangue (muco cutaneo)
• Cannula a parete sottile e rastremata (a doppia svasatura)
• Ago interno lubrificato, estraibile, in acciaio con punta a triplice affilatura e dotata di sfaccettatura dorsale (back-cut-grinding) per ridurre il trauma
• Cono di connessione luer/luer lock, resistente alla trazione
• N° 6 bande radio-opache incorporate nella parete della cannula, non a contatto con il sangue o i fluidi infusi
• Valvola unidirezionale antireflusso in silicone
• Alette flessibili prepiegate che permettono di impugnare l’ago cannula con più punti di appoggio
• Tappo/Membrana distale con microfori per un facile reflusso in fase di inserimento
• Accesso alla seconda via dotato di cappuccio di sicurezza con meccanismo a “battuta” (a scatto) con codice colore con sistema di chiusura automatica
• Camera di reflusso trasparente, dotata di tappo a tenuta
Tempi di permanenza consigliati:
BD non indica un tempo di permanenza minimo o massimo in situ per questo tipo di cateteri.
Il tempo di permanenza deve essere stabilito dalle procedure emanate dagli Enti, dalle linnee guida nazionali, da ogni contesto clinico e dalla condizione clinica specifica del singolo paziente.
Se ben gestito e costantemente monitorato (come indicato dalle linee guida CDC- Atlanta e INS), il dispositivo può rimanere in situ per tempi superiori a 72/96 ore.
Resistenza alle pressioni:
Massimo 188 psi
Destinazione d’uso / Indicazioni:
Catetere venoso periferico per l’incannulazione a breve termine, i prelievi ematici, il monitoraggio della pressione e la somministrazione endovenosa di liquidi.
Controindicazioni:
Nessuna nei limiti della destinazione d’uso del prodotto
Compatibilità con prodotti farmaceutici:
Si dichiara la conformità alle normative ISO ed EN in materia.
Non sono note limitazioni particolari nella scelta di fluidi o farmaci da somministrare.
È necessario attenersi a tutte le avvertenze, precauzioni, istruzioni e controindicazioni relative alle sostanze infuse, compresi fluidi, farmaci, sangue o emoderivati, e mezzi di contrasto, così come specificato dalle case farmaceutiche produttrici.
Specifiche tecniche:
• Cono di connessione luer/luer lock: Polipropilene trasparente
• Alette laterali di fissaggio: Polipropilene
• Cappuccio copricatetere: Polietilene
• Catetere/Cannula: Vialon X (Poliuretano Aromatico ad uso medicale)*
• Camera di reflusso trasparente: Polipropilene
• Membrana (tappo) di reflusso: Polipropilene
• Bande radiopache: Solfato di Bario
• Ago-mandrino: Acciaio inossidabile AISI 304
• Valvola unidirezionale: Gomma siliconica
• Cappuccio della valvola: Polietilene
• Tappo luer lock: Polipropilene
• Impugnatura: Polipropilene
• Sistema di protezione: Polipropilene
• Lubrificante: Silicone in quantità inferiore a 0,25mg/cm², limite massimo indicato dalla Farmacopea Ufficiale Italiana e e conforme alle norme ISO 7886-2 e ISO 7886-1
* Vialon™ è un poliuretano termoplastico, resistente al piegamento che si ammorbidisce a contatto con il flusso ematico e riduce quindi le sollecitazioni meccaniche sulle pareti dei vasi.
• Sterile: SI
• Presenza di lattice: NO
• Presenza di DEHP: NO
• Presenza di PVC: NO
• Modalità e durata di conservazione: Conservare in un luogo fresco ed asciutto lontano da sostanze chimiche
Conformità:
§ ISO 10993-1 “Biological Evaluation of Medical Devices Part 1: Guideline on Selection of Tests – Corrigendum 1”
§ISO 11137-1 “Sterilization of health care products. Radiation. Requirements for development, validation and routine control of a sterilization process for medical devices”
§ ISO 11607 “Packaging for Terminally Sterilized Medical Devices”
§ EN 594-1 “Conical Fittings with a 6% (Luer) Taper for Syringes, Needles and Certain Other Medical Equipment Part 1: General Requirements”
§ EN 594-2 “Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical equipment — Part 2: Lock fittings.”
§ ISO 14971 ” Medical Devices – Application of Risk Management to Medical Devices”
§ ISO 10555 Part 1 “Sterile, Single-Use Intravascular Catheters — Part 1: General Requirements”
§ ISO 10555 Part 5 “Sterile, Single-Use Intravascular Catheters — Part 5: Over-the-Needle Peripheral Catheters”
§ ISO 14971 “Medical devices — Application of risk anagement to medical devices”
§ EN 980 “Symbols for use in the labeling of medical devices”
Confezionamento ed etichettatura:
Il confezionamento primario e secondario è prodotto senza l’impiego di lattice, di ftalati e di PVC
Primario:
Peel-pack in blister preformato PVC Free e carta per uso medicale permeabile all’ossido di etilene riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conforme alla normativa ISO 11607, EN 980 ed EN 1041.
Secondario:
Cartone pressato riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conformi alla normativa EN 980 ed EN 1041.
Imballo:
Cartone ondulato riportante tutte le informazioni come prescritto dalle direttive 93/42/CEE e 2007/47/CE e conformi alla normativa EN 980 ed EN 1041.
Metodo di sterilizzazione del prodotto:
Irraggiamento, conforme ai requisiti stabiliti dalla norma ISO 11137-1.
Biocompatibilità:
Il prodotto è stato realizzato con materiali, coloranti ed inchiostri atossici.
I materiali utilizzati sono stati testati per valutare la tossicità secondo quanto indicato dalle normative ISO 10993-1.
Si dichiara l’apirogenicità del prodotto.
Smaltimento:
I dispositivi medici appuntiti, acuminati, contaminati da sangue o altri fluidi organici, devono essere smaltiti negli appositi contenitori ed eliminati tramite incenerimento. Lo smaltimento deve comunque avvenire in conformità alla direttive nazionali, comunitarie ed internazionali in materia. In ogni caso si consiglia di fare riferimento ai vigenti protocolli ospedalieri.
Controlli qualitativi:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazione degli organi preposti.
Modalità di conservazione:
A temperatura ambiente (non superiore ai 30°C), in luogo fresco e asciutto al riparo dai raggi solari diretti
Confezione: 50 Pezzi
AGO CANNULA, 2 VIE,
BD VENFLON 2 18G 1,3 x mm.32,VERDE CONF. 50 PZ
Descrizione
Ago catetere venoso periferico, monouso, sterile, con valvola di iniezione.
Catetere venoso periferico per l’incannulazione a breve termine, i prelievi ematici, il monitoraggio della pressione e la somministrazione endovenosa di liquidi.
NUMERO VIE: 2
CALIBRO: G18
DIAMETRO ESTERNO: 1,3 mm
LUNGHEZZA: 32 mm
FLUSSO ml/min: 80
CODICE COLORE: Verde
Caratteristiche generali
Caratteristiche generali:
• Valvola antireflusso in silicone, utilizzabile per infusion, per iniezioni o contemporaneamente per entrambe, dotata di cappuccino di sicurezzacon codice colore-
• Alette flessibili prepiegate che garantiscono un fissggio semplice e sicuro permettono di impugnare l’ago cannula con più punti di appoggio.
• Tappo distale con microfori che permette un flusso di aria sufficiente ad ottenere un reflusso veloce del sangue in fase di inserimento.
• Pulitura ago ad ultrasuoni.
• Smussatura dell’ago con taglio posteriore e la punta affusolata
• Alette flessibili prepiegate che garantiscono un fissaggio semplice e sicuro: permettono di impugnare l’ago cannula con più punti di appoggio
• Tappo Luer-Lock in polipropilene
• Tappo/Membrana distale con microfori che permette un flusso di aria sufficiente ad ottenere un reflusso veloce del sangue in fase di inserimento
• Accesso alla seconda via dotato di cappuccio di sicurezza con meccanismo a “battuta” (a scatto) con codice colore con sistema di chiusura automatica
• Camera di reflusso trasparente, dotata di tappo a tenuta
• Cannule ed imballaggi contraddistinti da diverso codice colore in relazione alla misura
• Ago mandrino a doppia svasatura, lubrificato.
Tempi di permanenza consigliati:
BD non indica un tempo di permanenza minimo o massimo in situ per questo tipo di cateteri.
Il tempo di permanenza deve essere stabilito dalle procedure emanate dagli Enti, dalle linnee guida nazionali, da ogni contesto clinico e dalla condizione clinica specifica del singolo paziente.
Se ben gestito e costantemente monitorato (come indicato dalle linee guida CDC- Atlanta e INS), il dispositivo può rimanere in situ per tempi superiori a 72/96 ore.
Materiali:
Fabbricato senza l’impiego di lattice (LATEX), di PVC e di Di‐2‐Etilesilftalato (DEHP).
– Cono di connessione luer/luer lock: Polipropilene
– Cappuccio copricatetere: Polietilene
– Catetere/Cannula: Politetrafluoretilene
– Camera di reflusso trasparente: Polipropilene
– Membrana (tappo) di reflusso: Polipropilene
– Ago‐mandrino: Acciaio inossidabile AISI 304
– Valvola unidirezionale: Metil vinil Polisiloxano
– Cappuccio della valvola: Polietilene
– Tappo luer lock: Polipropilene
– Lubrificante: Silicone in quantità inferiore a 0,25mg/cm², limite massimo indicato dalla Farmacopea Ufficiale Italiana e e conforme alle normeISO 7886‐2 e ISO 7886‐1
Sterilizzazione:
Ossido di Etilene.
Residui di ETO in conformità alle vigenti normative in materia, il residuo ETO riscontrato è variabile, a seconda del Gauge, tra 0,6μ e 3,5μ per dispositivo.
I test per la verifica dei residui di ETO seguono il metodo T814/2 in accordo alle norme ISO10993‐7.
Controlli di qualità:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazionedegliorganipreposti.
Controindicazioni:
Nessuna nei limiti della destinazione d’uso del prodotto
Compatibilità con prodotti farmaceutici:
Si dichiara la conformità alle normative ISO ed EN in materia.
Non sono note limitazioni particolari nella scelta di fluidi o farmaci da somministrare.
È necessario attenersi a tutte le avvertenze, precauzioni, istruzioni e controindicazioni relative alle sostanze infuse, compresi fluidi, farmaci, sangue o emoderivati, e mezzi di contrasto, così come specificato dalle case farmaceutiche produttrici.
• Sterile: SI
• Presenza di lattice: NO
• Presenza di DEHP: NO
• Presenza di PVC: NO
• Modalità e durata di conservazione: Conservare in un luogo fresco ed asciutto lontano da sostanze chimiche
Biocompatibilità:
Il prodotto è stato realizzato con materiali, coloranti ed inchiostri atossici.
I materiali utilizzati sono stati testati per valutare la tossicità secondo quanto indicato dalle normative ISO10993‐1.
Si dichiara l’apirogenicità del prodotto.
Smaltimento:
I dispositivi medici appuntiti, acuminati, contaminati da sangue o altri fluidi organici, devono essere smaltiti negli appositi contenitori ed eliminati tramite incenerimento.
Lo smaltimento deve comunque avvenire in conformità alla direttive nazionali, comunitarie ed internazionali in materia.
In ogni caso si consiglia di fare riferimento ai vigenti protocolli ospedalieri..
Controlli qualitativi:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazione degli organi preposti.
Modalità di conservazione:
A temperatura ambiente (non superiore ai 30°C), in luogo fresco e asciutto al riparo dai raggi solari diretti
Confezione: 50 Pezzi
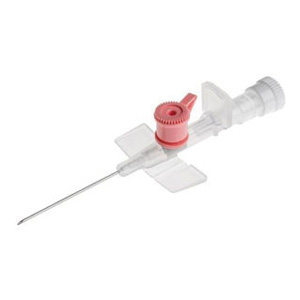
AGO CANNULA, 2 VIE,
BD VENFLON 2 20G, 1,1 x mm.32,ROSA CONF. 50 PZ.
Descrizione
Ago catetere venoso periferico, monouso, sterile, con valvola di iniezione.
Catetere venoso periferico per l’incannulazione a breve termine, i prelievi ematici, il monitoraggio della pressione e la somministrazione endovenosa di liquidi.
NUMERO VIE: 2
CALIBRO: G20
DIAMETRO ESTERNO: 1,1 mm
LUNGHEZZA: 32 mm
FLUSSO ml/min: 54
CODICE COLORE: Rosa
Caratteristiche generali
• Valvola antireflusso in silicone, utilizzabile per infusion, per iniezioni o contemporaneamente per entrambe, dotata di cappuccino di sicurezzacon codice colore-
• Alette flessibili prepiegate che garantiscono un fissggio semplice e sicuro permettono di impugnare l’ago cannula con più punti di appoggio.
• Tappo distale con microfori che permette un flusso di aria sufficiente ad ottenere un reflusso veloce del sangue in fase di inserimento.
• Pulitura ago ad ultrasuoni.
• Smussatura dell’ago con taglio posteriore e la punta affusolata
• Alette flessibili prepiegate che garantiscono un fissaggio semplice e sicuro: permettono di impugnare l’ago cannula con più punti di appoggio
• Tappo Luer-Lock in polipropilene
• Tappo/Membrana distale con microfori che permette un flusso di aria sufficiente ad ottenere un reflusso veloce del sangue in fase di inserimento
• Accesso alla seconda via dotato di cappuccio di sicurezza con meccanismo a “battuta” (a scatto) con codice colore con sistema di chiusura automatica
• Camera di reflusso trasparente, dotata di tappo a tenuta
• Cannule ed imballaggi contraddistinti da diverso codice colore in relazione alla misura
• Ago mandrino a doppia svasatura, lubrificato.
Tempi di permanenza consigliati:
BD non indica un tempo di permanenza minimo o massimo in situ per questo tipo di cateteri.
Il tempo di permanenza deve essere stabilito dalle procedure emanate dagli Enti, dalle linnee guida nazionali, da ogni contesto clinico e dalla condizione clinica specifica del singolo paziente.
Se ben gestito e costantemente monitorato (come indicato dalle linee guida CDC- Atlanta e INS), il dispositivo può rimanere in situ per tempi superiori a 72/96 ore.
Materiali:
Fabbricato senza l’impiego di lattice (LATEX), di PVC e di Di‐2‐Etilesilftalato (DEHP).
– Cono di connessione luer/luer lock: Polipropilene
– Cappuccio copricatetere: Polietilene
– Catetere/Cannula: Politetrafluoretilene
– Camera di reflusso trasparente: Polipropilene
– Membrana (tappo) di reflusso: Polipropilene
– Ago‐mandrino: Acciaio inossidabile AISI 304
– Valvola unidirezionale: Metil vinil Polisiloxano
– Cappuccio della valvola: Polietilene
– Tappo luer lock: Polipropilene
– Lubrificante: Silicone in quantità inferiore a 0,25mg/cm², limite massimo indicato dalla Farmacopea Ufficiale Italiana e e conforme alle normeISO 7886‐2 e ISO 7886‐1
Sterilizzazione:
Ossido di Etilene.
Residui di ETO in conformità alle vigenti normative in materia, il residuo ETO riscontrato è variabile, a seconda del Gauge, tra 0,6μ e 3,5μ per dispositivo.
I test per la verifica dei residui di ETO seguono il metodo T814/2 in accordo alle norme ISO10993‐7.
Controlli di qualità:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazionedegliorganipreposti.
Controindicazioni:
Nessuna nei limiti della destinazione d’uso del prodotto
Compatibilità con prodotti farmaceutici:
Si dichiara la conformità alle normative ISO ed EN in materia.
Non sono note limitazioni particolari nella scelta di fluidi o farmaci da somministrare.
È necessario attenersi a tutte le avvertenze, precauzioni, istruzioni e controindicazioni relative alle sostanze infuse, compresi fluidi, farmaci, sangue o emoderivati, e mezzi di contrasto, così come specificato dalle case farmaceutiche produttrici.
• Sterile: SI
• Presenza di lattice: NO
• Presenza di DEHP: NO
• Presenza di PVC: NO
• Modalità e durata di conservazione: Conservare in un luogo fresco ed asciutto lontano da sostanze chimiche
Biocompatibilità:
Il prodotto è stato realizzato con materiali, coloranti ed inchiostri atossici.
I materiali utilizzati sono stati testati per valutare la tossicità secondo quanto indicato dalle normative ISO10993‐1.
Si dichiara l’apirogenicità del prodotto.
Smaltimento:
I dispositivi medici appuntiti, acuminati, contaminati da sangue o altri fluidi organici, devono essere smaltiti negli appositi contenitori ed eliminati tramite incenerimento.
Lo smaltimento deve comunque avvenire in conformità alla direttive nazionali, comunitarie ed internazionali in materia.
In ogni caso si consiglia di fare riferimento ai vigenti protocolli ospedalieri..
Controlli qualitativi:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazione degli organi preposti.
Modalità di conservazione:
A temperatura ambiente (non superiore ai 30°C), in luogo fresco e asciutto al riparo dai raggi solari diretti
Confezione: 50 Pezzi
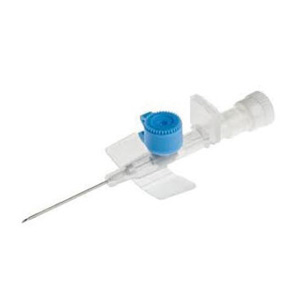
AGO CANNULA, 2 VIE,
BD VENFLON 2 22G 0,90X25mm, BLU CONF. 50 PZ.
Descrizione
Ago catetere venoso periferico, monouso, sterile, con valvola di iniezione.
Catetere venoso periferico per l’incannulazione a breve termine, i prelievi ematici, il monitoraggio della pressione e la somministrazione endovenosa di liquidi.
NUMERO VIE: 2
CALIBRO: G22
DIAMETRO ESTERNO: 0,90 mm
LUNGHEZZA: 25 mm
FLUSSO ml/min: 31
CODICE COLORE: Blu
Caratteristiche generali
• Valvola antireflusso in silicone, utilizzabile per infusion, per iniezioni o contemporaneamente per entrambe, dotata di cappuccino di sicurezzacon codice colore-
• Alette flessibili prepiegate che garantiscono un fissggio semplice e sicuro permettono di impugnare l’ago cannula con più punti di appoggio.
• Tappo distale con microfori che permette un flusso di aria sufficiente ad ottenere un reflusso veloce del sangue in fase di inserimento.
• Pulitura ago ad ultrasuoni.
• Smussatura dell’ago con taglio posteriore e la punta affusolata
• Alette flessibili prepiegate che garantiscono un fissaggio semplice e sicuro: permettono di impugnare l’ago cannula con più punti di appoggio
• Tappo Luer-Lock in polipropilene
• Tappo/Membrana distale con microfori che permette un flusso di aria sufficiente ad ottenere un reflusso veloce del sangue in fase di inserimento
• Accesso alla seconda via dotato di cappuccio di sicurezza con meccanismo a “battuta” (a scatto) con codice colore con sistema di chiusura automatica
• Camera di reflusso trasparente, dotata di tappo a tenuta
• Cannule ed imballaggi contraddistinti da diverso codice colore in relazione alla misura
• Ago mandrino a doppia svasatura, lubrificato.
Tempi di permanenza consigliati:
BD non indica un tempo di permanenza minimo o massimo in situ per questo tipo di cateteri.
Il tempo di permanenza deve essere stabilito dalle procedure emanate dagli Enti, dalle linnee guida nazionali, da ogni contesto clinico e dalla condizione clinica specifica del singolo paziente.
Se ben gestito e costantemente monitorato (come indicato dalle linee guida CDC- Atlanta e INS), il dispositivo può rimanere in situ per tempi superiori a 72/96 ore.
Materiali:
Fabbricato senza l’impiego di lattice (LATEX), di PVC e di Di‐2‐Etilesilftalato (DEHP).
– Cono di connessione luer/luer lock: Polipropilene
– Cappuccio copricatetere: Polietilene
– Catetere/Cannula: Politetrafluoretilene
– Camera di reflusso trasparente: Polipropilene
– Membrana (tappo) di reflusso: Polipropilene
– Ago‐mandrino: Acciaio inossidabile AISI 304
– Valvola unidirezionale: Metil vinil Polisiloxano
– Cappuccio della valvola: Polietilene
– Tappo luer lock: Polipropilene
– Lubrificante: Silicone in quantità inferiore a 0,25mg/cm², limite massimo indicato dalla Farmacopea Ufficiale Italiana e e conforme alle normeISO 7886‐2 e ISO 7886‐1
Sterilizzazione:
Ossido di Etilene.
Residui di ETO in conformità alle vigenti normative in materia, il residuo ETO riscontrato è variabile, a seconda del Gauge, tra 0,6μ e 3,5μ per dispositivo.
I test per la verifica dei residui di ETO seguono il metodo T814/2 in accordo alle norme ISO10993‐7.
Controlli di qualità:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazionedegliorganipreposti.
Controindicazioni:
Nessuna nei limiti della destinazione d’uso del prodotto
Compatibilità con prodotti farmaceutici:
Si dichiara la conformità alle normative ISO ed EN in materia.
Non sono note limitazioni particolari nella scelta di fluidi o farmaci da somministrare.
È necessario attenersi a tutte le avvertenze, precauzioni, istruzioni e controindicazioni relative alle sostanze infuse, compresi fluidi, farmaci, sangue o emoderivati, e mezzi di contrasto, così come specificato dalle case farmaceutiche produttrici.
• Sterile: SI
• Presenza di lattice: NO
• Presenza di DEHP: NO
• Presenza di PVC: NO
• Modalità e durata di conservazione: Conservare in un luogo fresco ed asciutto lontano da sostanze chimiche
Biocompatibilità:
Il prodotto è stato realizzato con materiali, coloranti ed inchiostri atossici.
I materiali utilizzati sono stati testati per valutare la tossicità secondo quanto indicato dalle normative ISO10993‐1.
Si dichiara l’apirogenicità del prodotto.
Smaltimento:
I dispositivi medici appuntiti, acuminati, contaminati da sangue o altri fluidi organici, devono essere smaltiti negli appositi contenitori ed eliminati tramite incenerimento.
Lo smaltimento deve comunque avvenire in conformità alla direttive nazionali, comunitarie ed internazionali in materia.
In ogni caso si consiglia di fare riferimento ai vigenti protocolli ospedalieri..
Controlli qualitativi:
L’intero ciclo produttivo dei prodotti Becton Dickinson è realizzato nel rispetto delle più rigorose specifiche internazionali ed è sottoposto al controllo ed all’approvazione degli organi preposti.
Modalità di conservazione:
A temperatura ambiente (non superiore ai 30°C), in luogo fresco e asciutto al riparo dai raggi solari diretti
Confezione: 50 Pezzi
PERCHé SCEGLIERE
ALPATRIS?
> Esperienza
> Professionalità
> Competenza

COMPILA IL FORM PER RICEVERE MAGGIORI INFORMAZIONI
OPPURE CHIAMACI AL NUMERO 091.6859838




